ISP no tiene purificado el virus de la influenza: https://goo.su/FJEtRY
La vacuna analizada es la Influvac Tetra del laboratorio Abbott temporada 2024, la cual corresponde a un antigripal-antígeno de superficie inactivado, coloquialmente conocido como “virus inactivado”. Fue adquirida en una farmacia de venta libre en Chile y antes de ser analizada se mantuvo en las condiciones que recomienda el fabricante.
El análisis que se le pudo realizar fue solo observacional, utilizando microscopia óptica con luz blanca, y lentes con magnificacion de 10 x y 100x.
Descripción Microscopio:
Microscopio óptico Olympus, con luz blanca y lente objetivo de magnificación 10x con apertura numérica de 0.25 para la gota líquida y lente objetivo de magnificación 100x con apertura numérica de 0.90 para la gota seca.
Observación general:
Se observaron varias gotas tanto líquidas como secas, fueron montadas en portaobjetos para microscopía de superficie lisa y borde pulido. Para los análisis en seco las gotas se dejaron secar a temperatura ambiente. En promedio cada gota demora unos 20 minutos en secar.

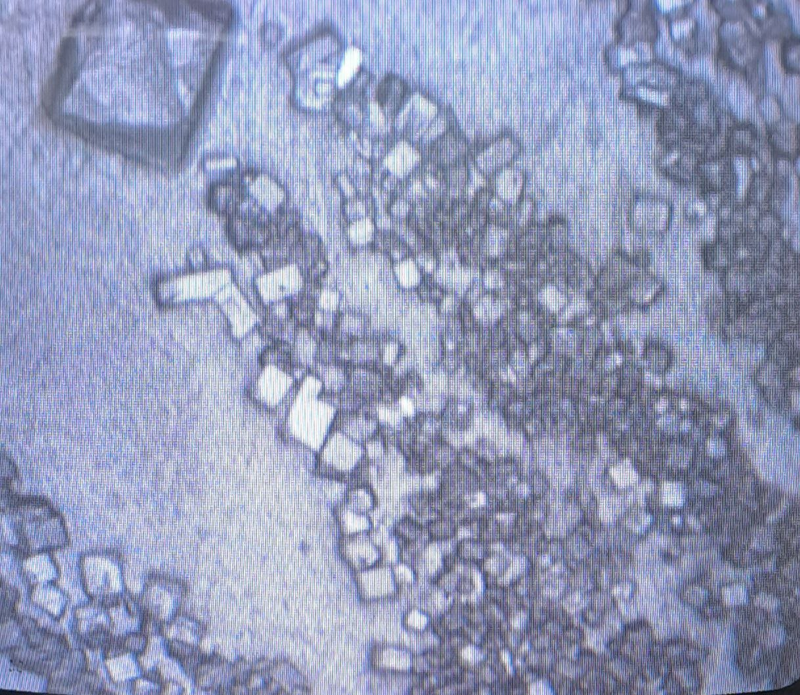
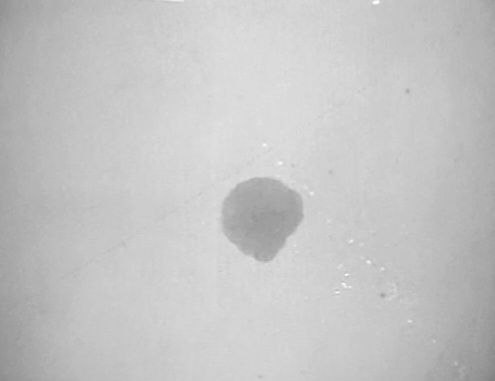
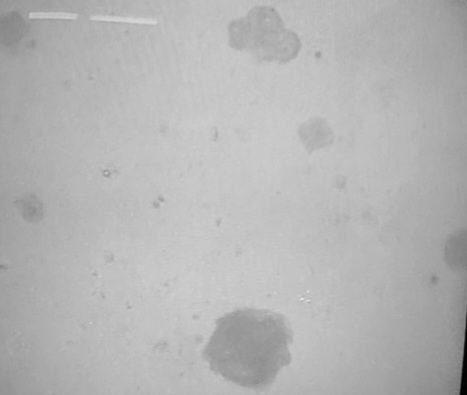
Gota seca:
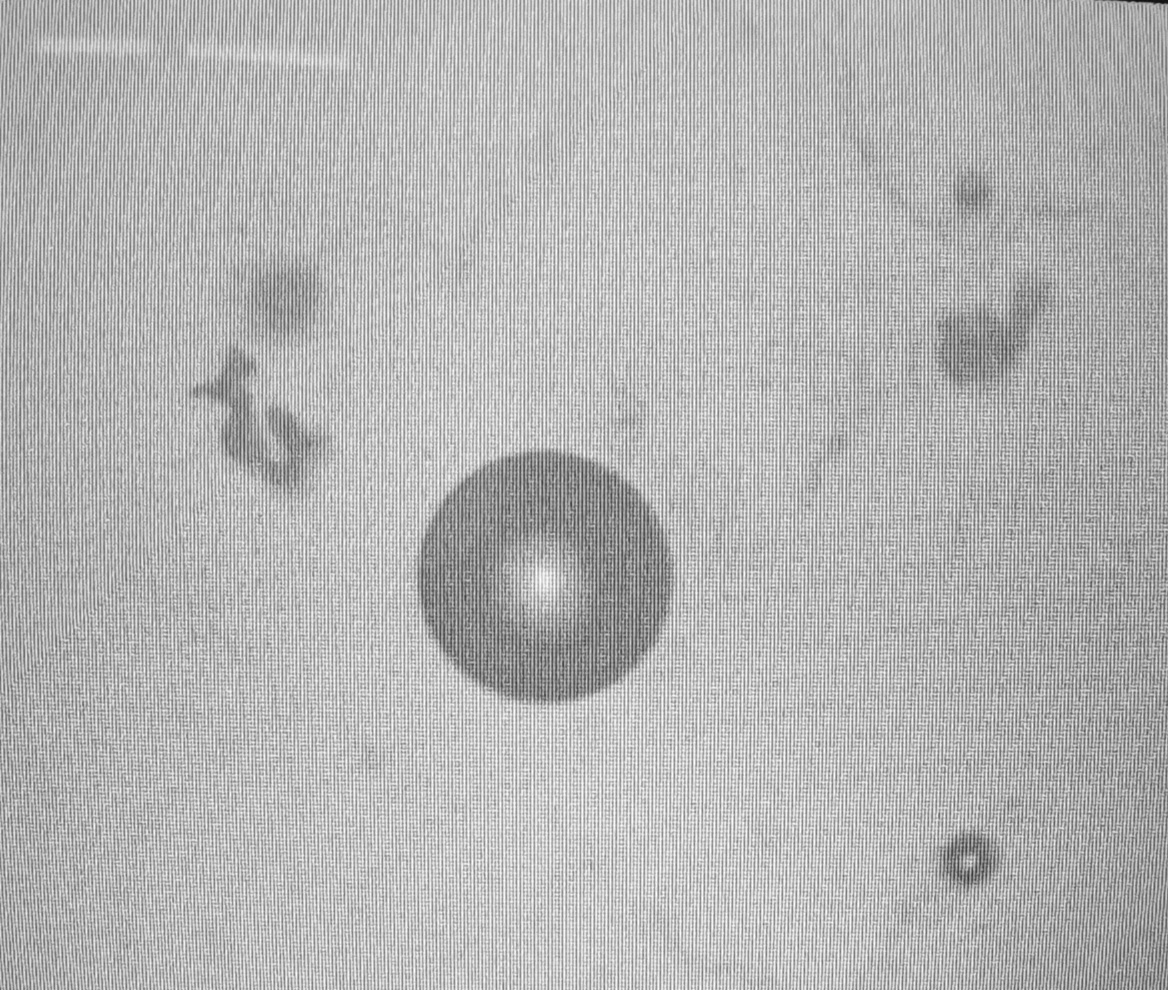
Lo que se puede observar en las siguientes imágenes, son cristales de los excipientes utilizados. Básicamente son cristales de sal y otras sales, que declara el fabricante en el prospecto de la vacuna. En parte corresponde a la solución salina que dice el fabricante contener.
Lista de excipientes declaradas por el fabricante en el prospecto:
Cloruro de potasio, potasio dihidrógeno fosfato, fosfato disódico dihidrato, cloruro de sodio, cloruro de calcio dihidrato, cloruro de magnesio hexahidrato y agua para inyecciones.
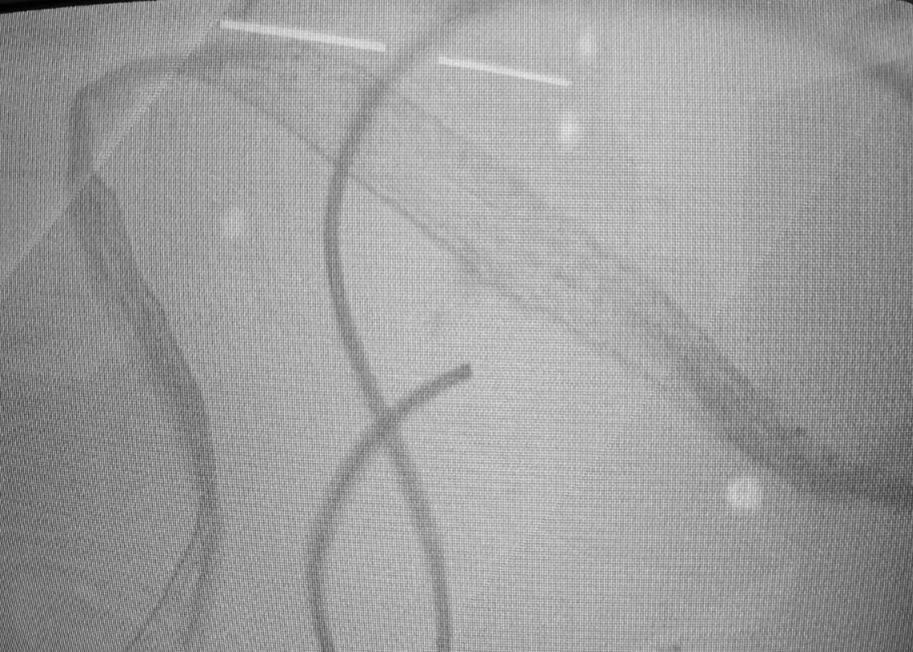
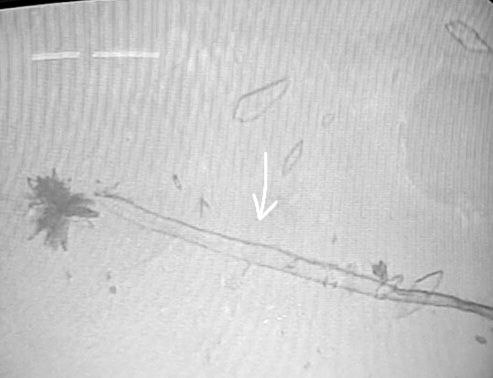
Gota líquida:
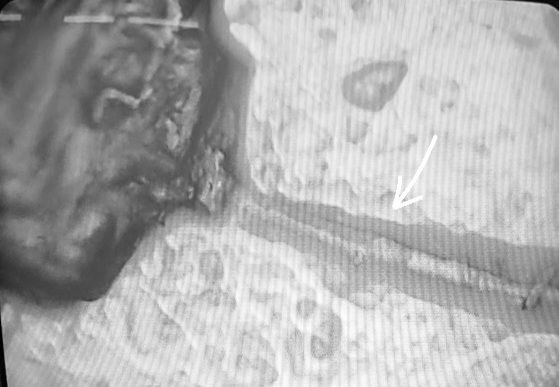
1.Para gotas líquidas, se encontraron muchas hebras y microburbujas. Las hebras muestran correspondencia visual con cintas de grafeno, muy utilizado en biomedicina como adyuvante. Estas cintas de grafeno no aparecen declaradas por el fabricante en el prospecto.
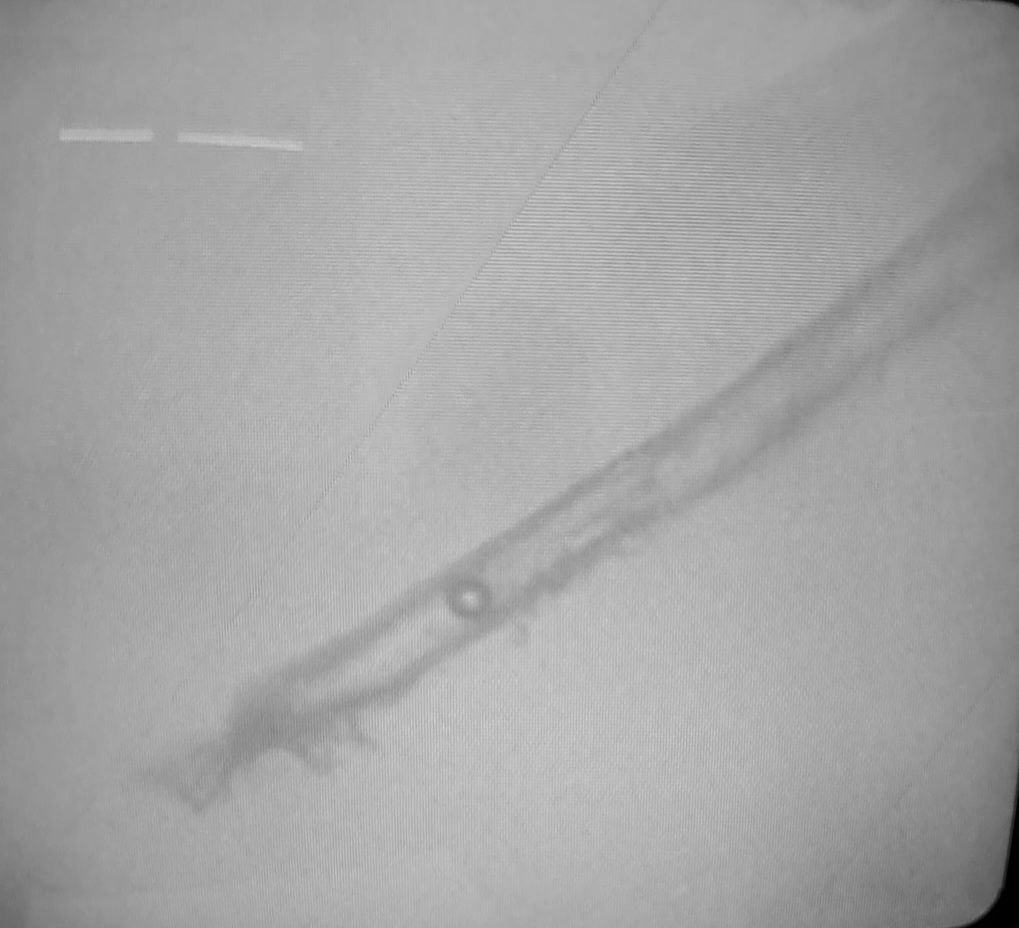
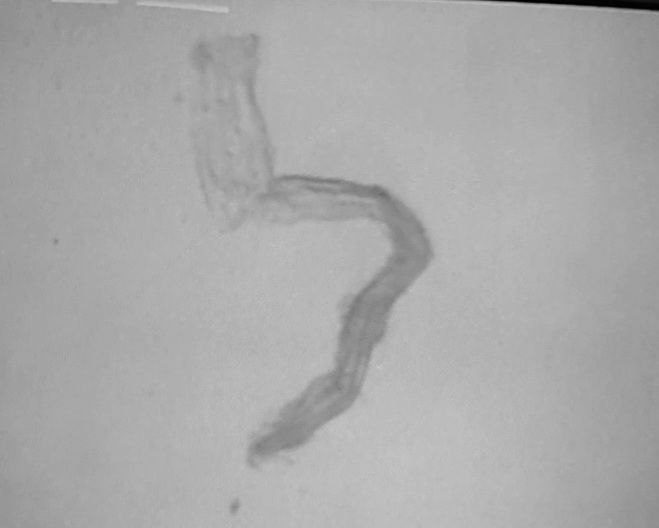
2.En la siguiente secuencia de imágenes, se puede observar una hebra de grafeno, en una gota líquida, esa misma gota se dejó secar a temperatura ambiente para observar que le ocurría a la hebra de grafeno. Conclusión: la hebra de grafeno inmutable. No sufre cambios al secar la vacuna.
3.Se pueden apreciar, a su vez, microburbujas que se autoensamblan, se buscan y se unen formando comunicación entre ellas..se produce una brillantéz cuando se establece dicha comunicación.
También se descubrió que las microburbujas se producen en mayor cantidad contra mas fuerte se presione el émbolo de la jeringa, luego se “atraen” y se unen, y permacen juntas, pero cuando la gota se seca éstas microburbujas se revientan y muestran las hebras de grefeno ya mencionadas.
Laboratorio Abbott elimina información de la vacuna de la influenza
Sin embargo, todo contenido eliminado de la web se puede encontrar desde la plataforma WAYBACK MACHINE (https://web.archive.org/web/20230420172419/https://www.medicine.abbott/cl/products/influvac.html) lo cual nos permitió recuperar la siguiente información respecto a este inoculo (compruébelo usted mismo haciendo clic en el enlace anterior).
INFLUVAC
Vacuna anti-influenza
Suspensión inyectable
COMPOSICIÓN
Cada dosis de vacuna contiene:
Antígenos de superficie inactivados del virus influenza de las cepas (+):
– A/Michigan/45/2015 (H1N1) pdm09 (*) 15 mcg HA
– A/Switzerland/8060/2017 (H3N2) (**) 15 mcg HA
– B/Colorado/06/2017 (*) 15 mcg HA
(*) Cepa que deriva de (A/Singapore/gp1908/2015, IVR-80)
(**) Cepa que deriva de (A/Brisbane/1/2018, NYMC X-311)
(*) Cepa que deriva de (B/Maryland/15/2016, NYMC BX-69A)
(+) Virus de la influenza cultivados en huevos embronados de gallina.
(++) Antígenos de hemaglutinina.
Excipientes: Cloruro de potasio, fosfato monobásico de potasio, fosfato disódico dihidrato, cloruro de sodio, cloruro de calcio dihidrato, cloruro de magnesio hexahidrato y agua para inyectables.
INDICACIONES
Profilaxis de influenza, especialmente aquellas asociadas a mayor riesgo y complicaciones. Influvac está indicada en adultos y niños desde los 6 meses de edad y su uso debe basarse en recomendaciones oficiales. La vacunación es particularmente recomendada para las siguientes categorías de pacientes, dependiendo de las políticas de inmunización nacional:
– Personas mayores de 65 de años de edad, independiente de su condición de salud.
– Adultos y niños con enfermedades crónicas del sistema pulmonar y cardiovascular, incluyendo asma.
– Adultos y niños con enfermedades metabólicas crónicas, tales como diabetes mellitus.
– Adultos y niños con disfunción renal crónica.
– Adultos y niños con inmunodeficiencias debido a enfermedad o medicación inmunosupresora (ej. citostáticos o corticoides) o radioterapia.
– Niños y adolescentes (6 meses – 18 años) que reciben medicación a largo plazo conteniendo ácido acetilsalicílico y podrían tener por lo tanto un riesgo de desarrollar el síndrome de Reye luego de un cuadro de influenza.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN
La dosis usual recomendada es:
Adultos: 0,5 mL.
Población pediátrica
– Niños de 36 meses y mayores: 0,5 mL.
– Niños desde 6 meses a 35 meses: Los datos clínicos a esta edad son limitados. Se pueden utilizar dosis de 0,25 o 0,5 mL. La dosis administrada debe estar de acuerdo con las recomendaciones nacionales vigentes.
– Los niños que no han sido previamente vacunados, requerirán una segunda dosis después de un intervalo de al menos 4 semanas.
– Niños de menos de 6 meses: La seguridad y eficacia de Influvac en niños menores de 6 meses no se ha establecido. No existen datos disponibles.
La inmunización debe realizarse por vía intramuscular o vía subcutánea profunda. Influvac debe alcanzar la temperatura ambiente antes de usar. Agitar e inspeccionar visualmente antes de la administración.
CONTRAINDICACIONES
– Hipersensibilidad a las sustancias activas, a cualquiera de los excipientes de la formulación o a cualquier componente que pueda estar presente como traza, ovoalbúmina, proteína de ave, formaldehído, bromuro de cetiltrimetilamonio, polisorbato 80 o gentamicina.
–La inmunización deberá ser postergada en pacientes / niños con estado febril o infección aguda.
PRECAUCIONES Y ADVERTENCIAS
– Al igual que con toda vacuna inyectable, debe estar disponible tratamiento y supervisión médica apropiada en caso de reacciones anafilácticas luego de la administración de la vacuna.
– Influvac no debe ser administrada intravascularmente bajo ninguna circunstancia.
– Las reacciones relacionadas con la ansiedad, inclyendo reacciones vasovagales (sincope), hiperventilación o reacciones relacionadas con el estrés pueden producirse antes o después de cualquier vacunación como respuesta psicogénica a la inyección con aguja. Esto puede ir acompañado de varios signos neurológicos como trastornos visuales transitorios, parestesias y movimientos tónico-clónicos durante la recuperación. Es importante que haya procedimientos para evitar lesiones por desmayos.
– Pacientes con inmunosupresión endógena o iatrogénica pueden presentar una respuesta inmunológica disminuida.
– Embarazo: Las vacunas de influenza inactivadas se pueden usar en todas las etapas del embarazo. Bases de datos más amplias sobre seguridad están disponibles para el segundo y tercer trimestre, sin embargo, los datos del uso de vacuna de influenza en todo el mundo no indican resultado adverso materno y fetal atribuible a la vacuna.
– Lactancia: Influvac 2017 puede ser usado durante la lactancia.
– Fertilidad: No existen datos disponibles en fertilidad.
– Síndrome de Guillain-Barré: Se ha notificado aparición del Síndrome de Guillian-Barré (SGB) asociado temporalmente a la administración de la vacuna anti-influenza en tasas estimadas de 1 caso por millón de dosis administradas. Si se ha producido SGB en las 6 semanas posteriores a la anterior vacunación anti-influenza, la decisión de administrar Influvac debe basarse en una cuidadosa consideración de los posibles riesgos y beneficios.
INTERACCIONES
– Influvac puede ser administrado con otras vacunas al mismo tiempo. La inmunización se debe realizar en distintas extremidades. Se hace notar que los efectos adversos pueden ser intensificados.
– La respuesta inmunológica puede verse disminuida si el paciente está en tratamiento con inmunosupresores.
– Se han observado después de la vacunación contra la influenza resultados falsos positivos en los test serológicos que usan el método Elisa para detectar anticuerpos contra HIV1, hepatitis C y especialmente HTLV1. La técnica Western Blot refuta los resultados falsos positivos del test de Elisa. Las reacciones transitorias de falsos positivos pueden deberse a una respuesta IgM de la vacuna.
REACCIONES ADVERSAS
Reacciones adversas observadas en estudios:
La seguridad de las vacunas inactivadas trivalentes para la influenza es evaluada en estudios clínicos abiertos, no controlados, realizados como requerimiento de actualización anual, incluyendo al menos a 50 adultos entre 18 y 60 años de edad y al menos a 50 adultos mayores de 60 años. La evaluación de seguridad se realiza durante los tres primeros días después de la vacunación.
Los efectos no deseados fueron observados durante los estudios clínicos con las siguientes frecuencias: Muy común (>1/10), común (≥1/100, <1/10), poco común (≥1/1.000, <1/100).
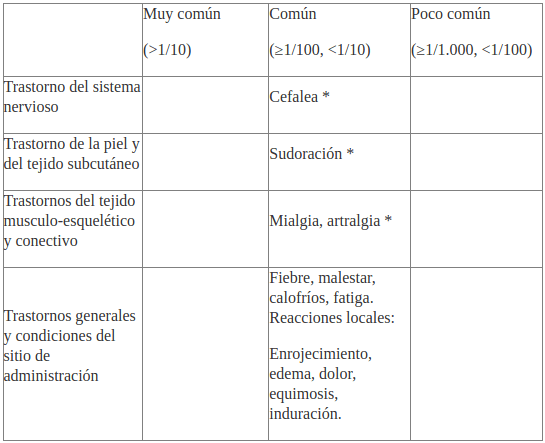
(*) Estas reacciones generalmente desaparecen sin tratamiento después de 1-2 días.
Reacciones adversas reportadas de la vigilancia post-comercialización:
Las reacciones adversas reportadas de la vigilancia post-comercialización sumadas a las observadas en estudios clínicos son:
– Trastornos del sistema sanguíneo y linfático: Trombocitopenia transitoria y linfoadenopatía transitoria
– Trastornos del sistema inmune: Reacciones alérgicas, en raros casos llevando a shock, angioedema.
– Trastornos del sistema nervioso: Neuralgia, parestesia, convulsiones febriles, trastornos neurológicos tales como encefalomielitis, neuritis y síndrome de Guillain Barré.
– Trastornos vasculares: Vasculitis asociada en muy raros casos con compromiso renal transitorio.
– Trastornos de la piel y tejido subcutáneo: Reacciones cutáneas generalizadas incluyendo prurito, urticaria y rash no específico.