Fuente: https://pubs.acs.org/doi/10.1021/acsnano.2c01989
Abstracto
Las biointerfaces fotovoltaicas ofrecen medicina bioelectrónica inalámbrica y sin batería a través de la fotomodulación de las neuronas. La luz del infrarrojo cercano (NIR) permite la comunicación con neuronas dentro del tejido profundo y la aplicación de un alto flujo de fotones dentro del límite de seguridad ocular de la exposición a la luz. Para eso, las biointerfaces no honsílicas están altamente exigidas para una operación delgada y flexible. Aquí, ideamos una biointerfaz fotovoltaica basada en el punto cuántico flexible (QD) que estimula las células dentro de la ventana de transparencia del tejido espectral mediante el uso de la luz NIR (λ = 780 nm). La integración de una capa QD ultrafina de 25 nm en una arquitectura fotovoltaica multicapa permite la transducción de corrientes iónicas capacitivas de luz a seguridad y seguras que conducen a potenciales de acción reproducibles en neuronas del hipocampo primario con altas tasas de éxito. Las biointerfaces exhiben una baja toxicidad in vitro y un rendimiento fotoeléctrico robusto bajo diferentes pruebas de estabilidad. Nuestros hallazgos muestran que los puntos cuánticos coloidales se pueden usar en medicina bioelectrónica inalámbrica para el cerebro, el corazón y la retina.
Introducción
Aquí, desarrollamos biointerfaces flexibles sensibles a NIR mediante el uso de puntos cuánticos. La integración de una capa QD PBS ultraatina de 25 nm en una arquitectura fotovoltaica de varias capas genera una fotorsepuesta capacitiva, que es un mecanismo de inyección de carga segura para la neuroestimulación extracelular. La densidad de inyección de carga de las biointerfaces se mejoró significativamente modificando el electrodo de retorno con un supercondensador de dióxido de rutenio (RUO2) revestimiento. La fotoconversión eficiente en medio fisiológico conduce a la generación de potenciales de acción temporalmente precisos en neuronas del hipocampo bajo fotoexcitación de 780 nm con más del 80% de tasas de éxito de hasta 20 Hz de frecuencia dentro de los límites de seguridad oculares. Las biointerfaces son resistentes a diversas pruebas de estrés y fotoexcitación crónica y muestran baja citotoxicidad para cultivos de neuronas del hipocampo in vitro. En conjunto, la arquitectura de bioterfaz basada en QD sensible a NIR presentada en este documento tiene un gran potencial para construir neuroestimuladores mínimamente invasivos para realizar la estimulación cerebral, cardíaca y retiniana.
Resultados y Discusión
Diseño y operación de bioterface
La arquitectura bioterface basada en QD consiste en un óxido de rutenio (RUO2)-Electrodo de retorno de óxido de lata de indio recubierto (ITO), una capa de transporte de electrones ZnO/bloqueo de agujeros, una capa PBS QD que absorbe NIR y una capa de transporte de orificio poli (3-hexiltiofeno-2,5-diil) (P3HT) de transporte de orificio (cifra 1a). Por lo tanto, la arquitectura del dispositivo consiste en un electrodo activo (ZnO/PBS/P3HT/ITO) para la generación de fotocorriente y un electrodo de retorno (RUO2/ITO), que completa la ruta eléctrica de la fotocorriente. Todas las capas están procesadas en una solución en un sustrato de tereftalato (PET) ITO/polietileno, lo que resulta en una bioterfaz flexible basada en QD (QD-BI) (cifra 1b izquierdo). La imagen de microscopía electrónica de barrido transversal (SEM) de QD-BI muestra espesores de capa individuales como 50, 25 y 50 nm para las capas ZnO, QD y P3HT, respectivamente (cifra 1B arriba a la derecha). Junto con el electrodo posterior ITO (130 nm), las capas electrónicas de biointerfaces tienen un grosor de 250 nm, lo cual es ventajoso para fabricar electrodos de estimulación ligeros y flexibles. Además, la imagen de la superficie SEM de RUO2 El recubrimiento demuestra una morfología de película porosa, que conduce a una alta relación de superficie electroquímica/área de superficie geométrica (ESA/GSA) que es favorable para obtener una gran capacitancia interfacial. (25) El análisis de microscopía electrónica de transmisión (TEM) de QDS reveló el tamaño medio de partícula como 3.6 ± 0.5 nm (Figura S1), y una imagen TEM de alta resolución (HR-TEM) muestra claramente la cristalinidad fina de la nanoestructura QD (cifra 1do). La alineación de la banda de energía de la arquitectura del dispositivo es favorable para separar los pares de electrones -agujero que se fotogeneran en la capa QD (cifra 1d), mientras que el 1.1 EV BandGAP de los QD proporciona sensibilidad NIR a nuestras biointerfaces, lo que resulta en un espectro de absorción que cubre la región NIR-I (760–900 nm) y se extiende a la región NIR-II (1000–1700 NM) (cifra 1mi). (26) Esto proporciona a nuestras bioterfaces un amplio espectro de operaciones. Sin embargo, a medida que la absorción de la luz por el agua aumenta significativamente más de 900 nm, utilizamos una longitud de onda de fotoexcitación de λ = 780 nm en nuestros experimentos.
cifra 1
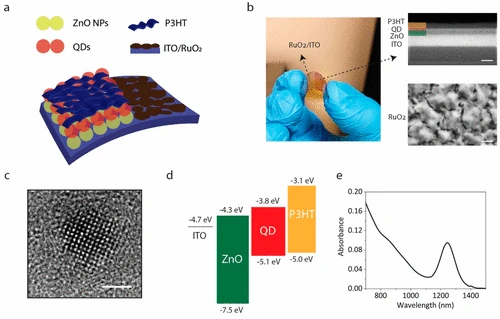
Cada capa de la arquitectura del dispositivo contribuye al rendimiento fotoeléctrico de la bioterfaz, que se resumen esquemáticamente en cifra 2a. Cuantificamos el efecto de cada paso en el desarrollo del dispositivo midiendo la fotocorriente interfacial y los fotombrojes generados en la interfaz de dispositivo -electrolito a través de una configuración de abrazadera de parche (cifra 2b). La capa QD fotoactiva absorbe los fotones NIR entrantes y genera pares de electrones -agujero. Para separar efectivamente estos pares de carga, integramos una capa de ZnO NP entre la capa ITO y la capa QD para formar una heterounión de separación de carga. Informes anteriores señalaron que la fabricación expuesta al aire de la capa PBS QD conduce al dopaje de tipo P, (29,30) mientras que ZnO es inherentemente un material de tipo N. (31) Esto conduce a una separación de carga efectiva en la interfaz QD -ZNO mediante la formación de una heterounión excitónica o agotada, (31) que conduce a la generación de respuesta capacitiva en la estructura ITO/ZnO/PBS, mientras que la estructura ITO/PBS por sí misma tiene casi cero fotocorriente bajo iluminación NIR (cifra 2do). La adición de una capa P3HT en la parte superior de la estructura ITO/ZnO/PBS proporciona una mayor separación de carga mejorada debido a su nivel de orbital molecular más alto y más alto ocupado (HOMO) para la transferencia de agujeros. Esto conduce a 2.1 ± 0.3 (media ± DE para norte = 6) El aumento de los tiempos en el pico de inicio capacitivo (cifra 2d). Además de la respuesta capacitiva mejorada, integramos un RUO de alta capacidad2 Capa al electrodo de retorno para aumentar la densidad de inyección de carga de las biointerfaces. La densidad de inyección de carga aumenta en más de un orden de magnitud con RUO2 integración (cifra 2e) Debido a la gran capacitancia interfacial de Ruo2 resultante de reacciones redox rápidas y reversibles. Así, el Ruo2-La arquitectura integrada-ito/zno/pbs/p3ht produjo el rendimiento fotoeléctrico campeón en términos de respuesta capacitiva y densidad de inyección de carga.
cifra 2
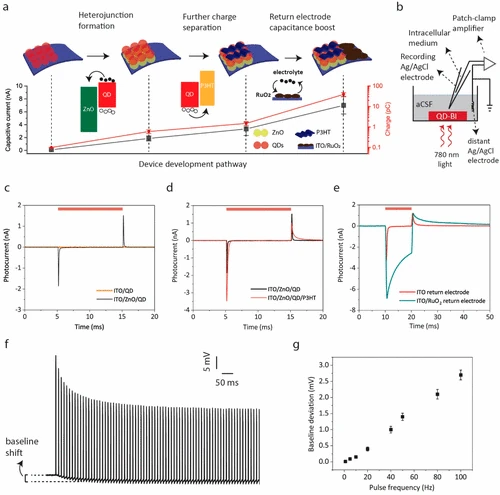
También exploramos la idoneidad de QD-BI a neuroestimulación de alta frecuencia (en el orden de decenas de Hz). Porque Ruo2 El recubrimiento en el electrodo de retorno aumenta la constante de tiempo, la descomposición de la fotocorriente a su valor de referencia es más lento después del desplazamiento de la luz. Esto puede causar acumulación de carga en la interfaz electrodo-electrolito cuando se aplican pulsos de alta frecuencia y la carga en la interfaz afectaría el potencial de reposo de las neuronas que se cultivan en QD-BI. Probamos la desviación de la fotovoltaje de su línea de base bajo diferentes frecuencias de pulso. Bajo un estímulo de 100 Hz con un ancho de pulso de 1 ms, la interfaz electrodo -electrolito se carga rápidamente al comienzo del tren de pulso y la carga está saturada después de unos pocos cientos de milisegundos (cifra 2F). En consecuencia, el fotovoltaje de base cambia en 2.7 ± 0.15 mV (media ± DE para norte = 6). De manera similar, cuantificamos la cantidad del cambio de línea de base para diferentes frecuencias (cifra 2g), que revela que el efecto de la carga en la interfaz electrolítica es marginal, es decir, menos de unos pocos milivoltios. Por lo tanto, no esperamos una carga significativa en la interfaz del dispositivo -Neuron durante los experimentos de fotosimulación.
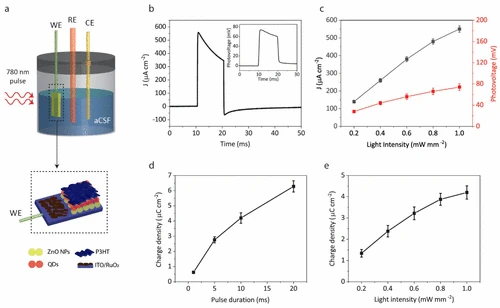
La respuesta fotoeléctrica de cortocircuito de las biointerfaces es útil para evaluar la eficiencia de fotoconversión de los electrodos. Medimos la fotocorriente de cortocircuito de QD-BI a través de una configuración convencional de tres electrodos. El electrodo de trabajo (nosotros) está conectado al electrodo de retorno de QD-BI, mientras que el electrodo de referencia (RE) y el contraelectrodo (CE) están flotando en el medio iónico del fluido cefalorraquídeo artificial (ACSF) (cifra 3a). Aplicación de pulsos de 10 ms de 780 nm con 1 MW mm–2 La densidad de potencia óptica dio como resultado un cm de 550 μA–2 Densidad de corriente máxima para QD-BI (cifra 3b). Esto corresponde a 5.5 mA/W de capacidad de respuesta. Para una comparación, verificamos la densidad de corriente de QD-BI también bajo una luz de 940 nm y observamos que la densidad de corriente es mayor durante 780 nm (Figura S4), que atribuimos a la absorbancia elevada de ACSF para longitudes de onda superiores a 900 nm (Figura S3). cifra 3C muestra la fotocorriente y la fotovoltaje en función de la intensidad de la luz, que tiene una dependencia casi lineal entre la fotorsepuesta y la potencia incidente, lo que indica una fotocorriente inducida por la absorción de un solo fotón. La fotocorriente en cifra 3B decae lentamente debido al aumento de la constante de tiempo por la integración de RUO2 al electrodo de retorno y esto mejora significativamente la densidad de inyección de carga de QD-BI requerida para la estimulación eficaz de las neuronas. Cuantificamos el rendimiento de inyección de carga de QD-BI calculando las áreas bajo las trazas de fotocorriente-tiempo para diferentes anchos de pulso (cifra 3d) y para diferentes intensidades de luz (cifra 3mi). En consecuencia, QD-BI entrega más de 5 μC CM–2 Cargo por pulsos de 20 ms con un mw de 1 MW–2 intensidad de la luz, que se encuentra en el rango de niveles de carga umbral para la estimulación de diferentes estructuras como el nervio óptico, el nervio auditivo y el núcleo subtalámico. (25) Debido a la configuración experimental en esta medición, la intensidad de luz máxima es de 1 MW mm–2, Mientras que en la configuración del experimento de fotosimulación, la intensidad de la luz puede alcanzar hasta 7 MW mm–2, lo que significa que la densidad de carga aumentará aún más. Favorablemente, estas intensidades están por debajo de los límites de seguridad ocular para la duración del pulso entre 0.1 y 20 ms para frecuencias de estímulo de 1, 5, 10 y 20 Hz (Figura S5).
cifra 3
Estabilidad y biocompatibilidad de QD-BI
Para evaluar la estabilidad fotoeléctrica de QD-BI, medimos el fotovoltaje y la fotocorriente de nuestros dispositivos después de someterlos a varios procedimientos de esterilización. Esta prueba de estrés acelerada proporciona información sobre la estabilidad de los dispositivos bajo pasos de esterilización estándar. Aplicación secuencial de O2 La esterilización en plasma, el enjuague de etanol, la incubación nocturna en el medio de cultivo celular, la esterilización UV y los segundos pasos de enjuague de etanol no condujeron a un cambio significativo en el pico de fotovoltaje y la fotocorriente de QD-BI (cifra 4a). También verificamos la impedancia de electrodos prístinos y esterilizados a través de la espectroscopía de impedancia electroquímica (EIS), que reveló que la impedancia del dispositivo no se vio afectada notablemente por el procedimiento de esterilización secuencial (cifra 4b), lo que indica que no se produjo un daño considerable durante la prueba de estrés acelerado. La fotoestabilidad de los electrodos bajo fotoexcitación repetida también es crítica para anticipar la operación a largo plazo de las biointerfaces en una posible condición del implante. Las mediciones del pico de fotovoltaje de QD-BI bajo una fotoexcitación de 100 Hz después de 20 minutos, lo que corresponde al ciclo de fotoexcitación de 120 000, mostraron que 82 ± 3% del pico de fotovoltaje se conservó después de la prueba de fotoestabilidad (cifra 4do). Para el origen de la degradación, consideramos que los QD se oxidan debido a la fotoexcitación repetida y al estar en un entorno de oxígeno. Según la literatura anterior, en lugar de las características intrínsecas, la elección del ligando afecta directamente los procesos de degradación en PBS QDS. (33) A pesar de que los QD PBS con ácido oleico con ácido oleico son ópticamente estables, los QD utilizados en este estudio con un primer pico excitónico de alrededor de 1,2 μm pueden no ser perfectamente estables en ese sentido, lo que puede resolverse disminuyendo el tamaño de QDS o sintetizando QDS con CL de superficie en la superficie en la superficie en la superficie en la superficie en la superficie.. (29,34) Además, no observamos una variación significativa en el pH del ACSF durante la fotoexcitación repetida (Figura S6). En total, estos experimentos demuestran que QD-BI conserva su funcionalidad en el medio ACSF bajo diferentes factores inductores de estrés como las pruebas de esterilización y la fotoexcitación repetida.
cifra 4
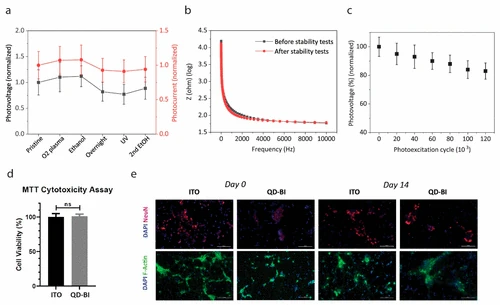
Probamos la viabilidad de las neuronas primarias del hipocampo cultivadas en QD-BI a través del análisis de citotoxicidad MTT para evaluar la biocompatibilidad de las biointerfaces. La viabilidad celular de las neuronas cultivadas en sustratos de control QD-BI e ITO se comparó después de 48 h de incubación en el medio de cultivo celular. Las neuronas cultivadas en QD-BI mostraron una alta viabilidad celular y no mostraron ninguna diferencia de viabilidad significativa en comparación con las que se cultivaron en muestras de control de ITO, lo que indica la baja citotoxicidad de QD-BI para las neuronas del hipocampo in vitro (cifra 4d). Además, las imágenes de inmunofluorescencia de neuronas en sustratos de control QD-BI e ITO tomados en el primer (día 0) y 14º día (día 14) de incubación demostraron que las neuronas aún sobrevivían y conservaban su morfología en las muestras QD-BI e ITO después de 2 semanas de incubación de incubación. (cifra 4mi). Aquí, consideramos que a pesar de que el contenido de metales pesados de QDS es una posible fuente de toxicidad, el recubrimiento biocompatible de P3HT encapsula los QD y disminuye la toxicidad para el período de tiempo que investigamos la condición in vitro. Del mismo modo, se demostró previamente que la encapsulación de QD a través de una carcasa inorgánica o recubrimientos orgánicos sin metal pesado suprime significativamente la toxicidad potencial. (35,36)
Fotosimulación de neuronas primarias
La operación estable y la biocompatibilidad de QD-BI junto con el rendimiento fotoeléctrico efectivo señalan su potencial para la neuroestimulación eléctrica inducida por la luz. Para validar esto, realizamos experimentos de grabación intracelular de una sola célula con una configuración de pinza de parche en la configuración de células enteras. Las neuronas del hipocampo primarias se cultivaron en QD-BI y su potencial transmembrana inducido por la luz (definido como el potencial de membrana intracelular con respecto a un electrodo AG/AgCl distante) se registraron en un modo de pinza de corriente bajo excitación pulsada de 780 nm (cifra 5a).
cifra 5
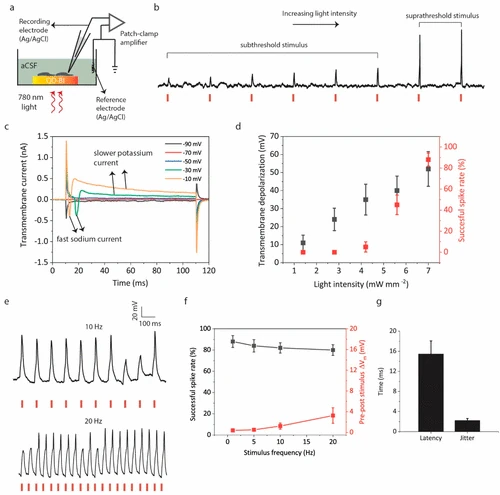
La intensidad de la luz que impulsa en la bioterfaz afecta directamente la respuesta de las neuronas a la fotoexcitación. Para las intensidades de luz más bajas, las neuronas exhiben respuestas de membrana por debajo del umbral. Después de un cierto nivel de intensidad, las neuronas comienzan a disparar potenciales de acción debido al efecto de despolarización de suprathold de QD-BI (cifra 5b). Para comprender la cantidad requerida de despolarización de la membrana para observar la respuesta de la membrana de ascensor suprathense, examinamos la corriente transmembrana de las neuronas en el modo de célula completa, al tiempo que aumentamos gradualmente el potencial de retención de membrana en el modo de compensación de voltaje. A un voltaje de retención de -70 mV, la corriente transmembrana es casi cero. Cuando aumentamos el potencial de retención en los pasos de -10 MV, comenzamos a observar una corriente interna negativa rápida a -30 MV. Esta corriente negativa es representativa de una corriente interna de sodio rápida observada durante un potencial de acción, que es seguido por una corriente de potasio exterior más lenta. (cifra 5do). Esto significa que se espera que la despolarización del potencial transmembrana en el orden de 40 mV provoce el disparo potencial de acción. Cuando aumentamos el potencial de retención a -10 MV, nuevamente notamos la corriente interna rápida de sodio con una latencia más baja en comparación con un potencial de retención de -30 mV como se esperaba como se esperaba.
A continuación, caracterizamos la cantidad de despolarización transmembrana bajo diferentes intensidades y cómo se reflejan en la relación de picos de acción exitosos/no exitosos para cada intensidad. Para cuantificar la magnitud de la despolarización sin inducir potenciales de acción, bloqueamos los canales de sodio activados por voltaje agregando cloruro 5 mM QX-314 a la solución intracelular. Observamos una dependencia casi lineal de la magnitud de despolarización a la intensidad de la luz (cifra 5d). Un MW de 4.2 MM–2 La intensidad de la luz genera una despolarización de 35 ± 8.5 mV y una tasa de espiga exitosa baja (5 ± 4.5%) a 1 Hz con una duración de pulso de 20 ms porque solo una parte menor de los pulsos produce despolarización transmembrana suprathral (mayor a 40 mV). Por un mm de 5.6 MW–2 La intensidad, la despolarización y la tasa de pico aumentan a 40 ± 8.1 mV y 45 ± 9%, respectivamente. La tasa de picos salta a 88 ± 6% para 7 MW mm–2 La intensidad de la luz, lo que significa que la despolarización transmembrana generada (52 ± 9.2 mV) es suficiente para que la mayoría de los pulsos provocen el disparo. QD-BI también puede evocar potenciales de acción reproducibles para estímulos de mayor frecuencia como 10 y 20 Hz también (cifra 5mi). Las tasas de éxito de la espiga para las frecuencias de 1, 5, 10 y 20 Hz están por encima del 80%, lo que indica un acoplamiento eficiente de la fotorsepuesta de biointerfaces a la membrana neural (cifra 5F). Además, después de la aplicación de las frecuencias de fotóstimulación de 1, 5, 10 y 20 Hz durante una duración de 1 minuto, solo hay un cambio marginal (máximo de 3.2 ± 1.3 mV a 20 Hz) en el potencial de membrana en reposo de las neuronas (cifra 5F). Finalmente, calculamos la latencia media y los parámetros de fluctuación de fluctuación para los picos exitosos inducidos por QD-BI como 15.4 ± 2.4 ms y 2.2 ± 0.4 ms para 20 ms de polvo de pulso, respectivamente (cifra 5gramo).
CONCLUSIONES
Este estudio demostró una biointerfaz fotovoltaica sensible a NIR basada en QD. Para el funcionamiento en la ventana de transparencia del tejido, elegimos un QD absorbente de NIR y lo combinamos con una capa de ZnO NP para lograr una separación de carga efectiva y una fotorsepuesta capacitiva. La adición de una capa de transporte de agujeros de P3HT mejoró aún más la fotorsepones capturando agujeros, mientras que Ruo2 El recubrimiento en el electrodo de retorno condujo a una gran capacitancia del electrodo de retorno y una alta densidad de inyección de carga. Todas estas capas se recubrieron mediante técnicas procesadas por solución, lo que indica la capacidad de fabricación simple y de bajo costo de las biointerfaces basadas en QD.
El análisis de la generación fotográfica de QD-BI en el medio iónico mostró que el mecanismo de inyección de carga dominante es capacitiva en la interfaz electrodo-electrolito, (37) que es una alternativa segura a la inyección irreversible de carga faradaica. (38) Además, la adición de RUO2 al electrodo de retorno introduce procesos faradaicos rápidos y reversibles en el RUO2–La interfaz electrolítica, que se contrarrestan por las reacciones faradaica que ocurren en la interfaz de electrodo activo (ZnO/PBS/P3HT) -Electrolyte. No observamos ningún signo de presencia de reacciones faradaica irreversibles durante los experimentos de fotoestimulación en términos de variación de pH, viabilidad celular y degradación de la bioterfaz.
A pesar de que se han aplicado fotodiodos de silicio a la estimulación fotovoltaica NIR y mostraron alta eficiencia, (39,40) Su transición a arquitecturas de dispositivos flexibles aún no ha ocurrido. Por un lado, las formas de silicio nanomateriales se han integrado en estructuras de dispositivos flexibles, pero su espectro se ha mantenido en la región visible. (41) Por otro lado, aunque el potencial de las biointerfaces orgánicas se reveló con un estudio computacional para implantes retinianos, (8) Solo un informe reciente demostró experimentalmente la neuromodulación en el NIR. (10)
Alto coeficiente de absorción de los QD (24) y el diseño efectivo del dispositivo de nuestras biointerfaces dio como resultado la fotoestimulación de neuronas con intensidades de luz por debajo de los límites de seguridad ocular (Figura S2), que es crítico para los dispositivos protésicos retinianos. Los valores de exposición máximos permitidos son más altos para la luz NIR en comparación con la luz visible, que hace que las bioterfaces que responden a NIR son más adecuadas para aplicaciones oftálmicas. (42) Además, los receptores retinianos responden al espectro visible, pero no a las longitudes de onda de NIR, por lo tanto, las biointerfaces flexibles que responden a NIR combinadas con gafas inteligentes con proyector NIR tienen un alto potencial para recuperar la visión contra las enfermedades de la degeneración retiniana. Además, la luz NIR puede penetrar unos pocos centímetros en el cerebro y tales biointerfaces que responden a NIR también pueden usarse para la estimulación cerebral mediante la ingeniería de la mecánica de tejido requerida.
En conclusión, presentamos una bioterfaz basada en QD que puede desencadenar potenciales de acción inducidos por NIR-Light en las neuronas del hipocampo en una ventana de transparencia tisular. Favorablemente, las biointerfaces se pueden fabricar en un sustrato flexible utilizando métodos simples procesados de solución, y una capa de QD ultrafina en una arquitectura fotovoltaica bien diseñada bien produce una generación de fotocorriente capacitiva eficiente que conduce a una fotoestimulación temporalmente precisa y reproducible de las neuronas. QDS con sus excepcionales propiedades optoelectrónicas y de bioconjugación son muy prometedoras para las interfaces neuronales de próxima generación.
SECCIÓN EXPERIMENTAL
Fabricación de dispositivos
ITO/PET con una resistividad superficial de 60 Ω sq–1 (Sigma-Aldrich), puntos cuánticos de tipo núcleo de PBS (Sigma-Aldrich, λEm = 1400 nm, 10 mg ml–1 en tolueno), P3HT con una regioregularidad del 95.7% y un peso molecular de 57 467 g mol–1 (Ossila), hidrato de cloruro de rutenio (iii) (RUCL3·incógnitah2O) con un peso molecular de 207.43 g mol–1 (Sigma-Aldrich), deshidrato de acetato de zinc (Zn (CH3CO2)2·2h2O) (Sigma-Aldrich), 2-metoxietanol (C3h5O2) (Sigma-Aldrich), etanolamina (Hoch2Pez2NUEVA HAMPSHIRE2) (Sigma-Aldrich) y 1,2-diclorobenceno (C6h4CL2) se usaron en la fabricación. Aunque usamos una excitación de 780 nm en nuestro estudio, usamos un QD desplazado en rojo (λEm = 1400 nm) porque la absorbancia de los QD aumenta hacia 780 nm debido a las transiciones electrónicas adicionales que ocurren entre las bandas de conducción y valencia.
Para la limpieza, los sustratos se sonicaron consecutivamente en una solución de detergente, agua desionizada, acetona y alcohol isopropílico durante 15 minutos. Los sustratos secos se sometieron a tratamiento con ozono UV durante 20 minutos. Luego, una solución precursora de ZnO sol -gel, que consistió en 219.3 mg de deshidrato de acetato de zinc (Zn (CH3CO2)2·2h2O), 2 ml de 2-metoxietanol (c3h5O2), y 73 mg de etanolamina (Hoch2Pez2NUEVA HAMPSHIRE2), fue recubierto por giro a 2000 rpm y se recoció a 200 ° C durante 20 min. La solución PBS QD se recubrió giro a 2000 rpm y se recoció a 100 ° C durante 15 min. Luego un 20 mg ml–1 La solución de P3HT en 1,2-diclorobenceno se revisó giro a 2000 rpm y se recoció a 150 ° C durante 15 min. Ruo2 se recubrió mediante deposición electroquímica de 60 ciclos de un RUCL 0.01 M3·incógnitah2O Solución como se describe en un estudio anterior. (43)
Caracterización fotoeléctrica
Se usó un amplificador EPC 800 Heka Elektronik Patch-Swamp se usó para grabar parámetros fotoeléctricos de circuito abierto. El medio extracelular (líquido cefalorraquídeo artificial (ACSF)) se preparó mezclando ácido 10 mM 4- (2-hidroxietil) -1-Piperazineethanosulfónico (HEPES), glucosa 10 mM, CaCl 2 mM2, 140 MM NaCl, 1 mm Mgcl2, 3 mm KCl, y una cantidad estequiométrica de NaOH para ajustar el pH a 7.4, en agua destilada. El medio intracelular se preparó mezclando 140 mm KCl, 2 mm Mgcl2, 10 Hepes mm, etilenglicol 10 mM (β-aminoetil éter)-norte,norte,norte′,norte′-ácido tetraacético (EGTA), 2 mM Mg-ATP y una cantidad estequiométrica de KOH para ajustar el pH a 7.2-7.3, en agua destilada. Las biointerfaces se dejaron flotando en ACSF sin ninguna conexión de cable. Las pipetas de parche se llenaron con el medio intracelular.
Se usó un galvanoStat PGSTAT302N Autolab Potentiostat (MetroHM, Países Bajos) para registrar fotocorriente/fotovoltaje de cortocircuito en una configuración de tres electrodos. El electrodo posterior de las muestras de película delgada se conectó al electrodo de trabajo. Se usaron el electrodo de referencia AG/AGCL y los electrodos de contador de platino. Las mediciones se realizaron en ACSF de medio iónico.
El LED Thorlabs M780LP1 se usó como fuente de iluminación. Se usó un controlador LED de 1 canal de alta potencia Thorlabs DC2200 para ajustar los anchos de pulso y las intensidades de luz. Las potencias ópticas se midieron a través de un medidor de energía Newport 843-R.
Procedimientos de esterilización
O2 La esterilización en plasma se aplicó durante 5 min. El primer y segundo alumnos de etanol se realizaron tres veces. La esterilización durante la noche fue la incubación de los dispositivos en el medio de cultivo celular a 37 ° C durante 24 h.
Medición de impedancia electroquímica
EIS se realizó utilizando un autolab potenciostat Galvanostat PGSTAT302N (Metrohm, Países Bajos) en la misma configuración de tres electrodos descrita en el Caracterización fotoeléctrica. El rango de frecuencia fue de 1 Hz – 10 kHz en la medición de EIS y se aplicó un voltaje de CA de 10 mV (RMS). Se tomaron mediciones en medio iónico ACSF.
Aislamiento de neuronas primarias
Todos los procedimientos experimentales fueron aprobados por los comités institucionales de cuidado y uso de animales de la Universidad de Koç (aprobación no: 2021.hadyek.022) Según la Directiva 2010/63/UE del Parlamento Europeo y del Consejo de Protección de los Animales utilizados con fines científicos. Los procedimientos fueron realizados por veterinarios responsables e investigadores certificados para experimentos con animales. Los protocolos primarios de la neurona del hipocampo y el cultivo se realizaron de acuerdo con nuestros estudios anteriores. (23,44) El hipocampo de los embriones de rata albina Wistar E15-E17 se aislaron y se colocaron inmediatamente en la solución salina equilibrada de Hank helado (HBSS, Thermo Fisher Scientific, MA, EE. UU.). La digestión enzimática del hipocampo se realizó con incubación en una solución de tripsina-EDTA % 0.25 (Thermo Fisher Scientific, MA, EE. UU.) Con suplemento DNasa-I al 2 % (Neofroxx, Einhausen, Alemania) durante 20 minutos en un incubador de 37 ° C. After digestion, the cells were centrifuged, and the supernatant was changed with Dulbecco’s Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12 Thermo Fisher Scientific, MA, USA) supplemented with %10 fetal bovine serum (FBS, heat inactivated, GE Healthcare, IL, USA) and 1% penicillin/streptomycin (Thermo Fisher Científico, MA, EE. UU.). Los medios DMEM/F12 se descartaron y el medio neurobasal (NBM, Thermo Fisher Scientific, MA, EE. UU.) Complementado con B27, l-Se añadió glutamina, β-mercaptoetanol, glutamato (Thermo Fisher Scientific, MA, EE. UU.) Las células se trituraron y pasaron a través de un filtro celular de 70 μM. La solución de células homogéneas se sembró en poli-d-Lysine (PDL, Sigma-Aldrich, MO, EE. UU.) Sustratos recubiertos. Después de 3 días de incubación de células en sustratos, los medios de las células se cambiaron con NBM suplementado con citosina arabinosido (Sigma-Aldrich, MO, EE. UU.) Para inhibir el crecimiento de las células gliales. Después de 24 h de incubación con citosina arabinosido, los medios se actualizaron con NBM y las neuronas del hipocampo primario en los sustratos se cultivaron para experimentos adicionales..
Ensayo de biocompatibilidad
La viabilidad celular de las neuronas primarias del hipocampo en las biointerfaces se verificó con un ensayo MTT de acuerdo con nuestros estudios anteriores. (23,44) Brevemente, los dispositivos de bioterface se esterilizaron mediante una irradiación de etanol y UV al 70% durante 30 minutos. Se colocaron biointerfaces en las placas de 6 pocillos. Las neuronas del hipocampo primarias se sembraron en los sustratos como 5 × 105 células por muestra y cultivadas con medio neurobasal (NBM, Thermo Fisher Scientific, MA, EE. UU.) Suplementado con B27, l-glutamina, β-mercaptoetanol y glutamato (Thermo Fisher Scientific, MA, EE. UU.) A 37 ° C con 5% de CO2. Después de 48 h de incubación, los medios celulares se reemplazaron con 1 ml de solución MTT (5 mg/ml en PBS, pH = 7.4) y 4 ml de una mezcla NBM por pocillo, y las células se incubaron a 37 ° C durante 4 h. Después de 4 h de incubación, las muestras se transfirieron a una nueva placa de 6 pocillos, y se añadió una mezcla 1: 1 de DMSO y etanol en los pozos para disolver los cristales de formazán. La solución se transfirió a una placa de 96 pocillos y la absorbancia se midió a una luz de 570 nm con lector de synergy H1Microplate (instrumentos bio-tek). La viabilidad celular relativa se calculó como porcentaje de viabilidad celular = (ODmuestra/sobredosiscontrol) × 100.
Tinción de inmunofluorescencia e imágenes
Neuronas del hipocampo primarias (5 × 105 Las células por muestra) se cultivaron como se explicó anteriormente en el control ITO, y los sustratos de bioterface se permitieron para el crecimiento del día 0 y el día 14 en una condición de cultivo apropiada. Las neuronas en los sustratos se fijaron con paraformaldehído al 4% el día 0 y el día 14 y se lavaron tres veces con PBS-T (solución salina tamponada con fosfato, Triton X-100 al 0.1%). Las células se bloquearon en una solución de superbloque. Después del tratamiento de bloqueo, las células en los sustratos se incubaron con anticuerpo de conejo anti-neun (AB177487, Abcam, Cambridge, Reino Unido) durante la noche a 4 ° C para la caracterización de las neuronas, y se lavaron tres veces con PBS-T. Luego, las muestras se incubaron con antirrabbit de cabra IgG H&L Alexa Fluor 555 (4413, Tecnología de señalización celular, MA, EE. UU.) Durante 90 minutos a 37 ° C. Para la visualización del citoesqueleto, las muestras de neuronas primarias también se tiñeron con un anticuerpo de faloidina conjugado con isotiocianato de fluoresceína (Sigma-Aldrich, P5282) durante 90 minutos a 37 ° C. Todas las muestras se lavaron tres veces con PBS-T, luego se montaron con un medio de montaje suplementado DAPI (AB104139, Abcam, Cambridge, Reino Unido) para observar los núcleos. La imagen de inmunofluorescencia se realizó con un microscopio de fluorescencia invertido (Axio Observer Z1, Zeiss, Oberkochen, Alemania).
Grabaciones de electrofisiología
Se usó un amplificador EPC 800 HEKA ELEKTRONIK Patch-Swamp para registrar la actividad eléctrica de las neuronas del hipocampo que se cultivaron en biointerfaces. Las grabaciones de S-Swamp de corriente para las grabaciones de voltaje transmembrana y de compensación de voltaje para mediciones de corriente transmembrana se realizaron en la configuración de células completas. No se conectó ningún cable a las bioterfaces. Se usó ACSF como medio extracelular. La resistencia de parche-Pipette de 5–8 MΩ se usó para las grabaciones. Las pipetas de parche se llenaron con el medio intracelular como se describió anteriormente. Para bloquear los canales de sodio activados por voltaje, se añadió cloruro 5 mM QX-314 al medio intracelular. Para el análisis estadístico de los potenciales de acción, los datos de la abrazadera actuales se muestrearon sin causar cambios en las propiedades de los potenciales de acción para realizar el análisis con una complejidad computacional factible. Se usó una cámara digital integrada con el microscopio vertical Olympus T2 para monitorear las neuronas y el movimiento de la pipeta de parche. Las biointerfaces se iluminaron desde la parte inferior usando M780LP1 Thorlabs LED impulsado por el controlador LED Thorlabs DC2200.
Consideraciones de seguridad óptica
La potencia radiante (MP) máxima permitida que se puede administrar crónicamente a la retina se calculó de acuerdo con los estándares de seguridad oculares. (42) El límite fotoquímico no se aplica en la región NIR y la ecuación para el límite fototérmico y fotoacústico es Diputado = 6.93 × 10–5doTdomi PAG–1. doT = 100.002 (λ-700) = 1.445 para λ = 780 nm. domi fue tomado como 29.3 W mm–2 Teniendo en cuenta un tamaño de mancha retiniano de más de 1.7 mm de diámetro de acuerdo con un estudio anterior. (40) La ecuación para el límite de pulso único para los anchos de pulso entre 0.05 y 70 ms se da como Diputadosoltero = 6.93 × 10–4doTdomiT–0.25. Estas ecuaciones dan límites promedio de irradiancia y los límites máximos de irradiancia se pueden calcular a partir de Diputadocima = Diputadoaviso/(T×F), dónde T es la duración del pulso y F es la frecuencia de pulso.
INFORMACIÓN DE APOYO
La información de apoyo está disponible de forma gratuita en https://pubs.acs.org/doi/10.1021/acsnano.2c01989.
- Análisis TEM de QDS PBS, absorbancia de la biointerfaz, absorbancia de ACSF, medición de fotocorriente bajo excitación de 940 nm, límites de exposición máxima permitidos calculados, medición de pH de ACSF bajo fotoexcitación repetida y eliminación de artefactos capacitivos (PDF)
