Efectos de las nanopartículas de óxido de grafeno sobre los biomarcadores del sistema inmunológico producidos por RAW 264.7 y cultivos de células sanguíneas enteras humanas
Nanomateriales 2018 , 8 (2), 125; https://doi.org/10.3390/nano8020125
Presentación recibida: 10 de diciembre de 2017/Revisado: 21 de enero de 2018/Aceptado: 22 de enero de 2018/Publicado: 24 de febrero de 2018
Palabras clave: nanopartículas de óxido de grafeno ; citotoxicidad ; activación de macrófagos ; respuesta inmune humoral
1. Introducción
El grafeno (G) es un material de carbono bidimensional (2-D), con una estructura hexagonal (red de panal) formada por átomos hibridados sp 2 , que ha sido aislado de su material parental tridimensional, el grafito [ 1 , 2 , 3 ]. El óxido de grafeno (GO) es un derivado de grafeno de una sola capa de carbono que contiene grupos funcionales que contienen oxígeno, como grupos carboxilo e hidroxilo [ 2 , 4 , 5 ]. Estos grupos se adquieren cuando el grafeno se oxida [ 2 ]. Estas nanopartículas de grafeno oxidado poseen características únicas como conductividad térmica y electrónica, resistencia mecánica superior y propiedades ópticas [ 6 ]. Debido a estas excepcionales propiedades fisicoquímicas de las nanopartículas de óxido de grafeno (GONP), tiene una amplia gama de aplicaciones en varios campos. Estos campos incluyen electroquímica, biomedicina, biodetección, administración de fármacos, baterías de alta capacidad energética y supercondensadores, por nombrar algunos. Sin embargo, estas propiedades no garantizan necesariamente que los GONP sean buenos portadores de medicamentos [ 2 , 5 ].Debido a las aplicaciones de las GONP, es inevitable que estas nanopartículas se liberen al medio ambiente y puedan afectar directa o indirectamente la salud humana. Por lo tanto, es imperativo que se investiguen los efectos de GO. Como las nanopartículas, debido a sus propiedades, pueden transportarse fácilmente, lo que altera la biodisponibilidad y afecta la toxicidad celular [ 7 ]. GO no se descubrió hasta 2004 y, desde su descubrimiento, pocos estudios han informado sobre sus efectos sobre el sistema inmunológico [ 2 ]. El óxido de grafeno indujo estrés oxidativo e inmunotoxicidad in vivo en el pez cebra [ 1 ]. Tras la exposición in vitro a GONP, se registraron disminución de la viabilidad celular, daño en el ADN, aumento de la producción de especies reactivas de oxígeno (ROS) e inducción de factores inflamatorios [ 4 , 8 , 9 ]. Las citoquinas seleccionadas en este estudio in vitro (es decir, IL-6, IL-10 e IFNγ) son indicativas de los sistemas inmunológicos inflamatorio, humoral y celular, respectivamente. Cada uno de ellos desempeña roles diferentes pero interconectados. IL-6 tiene la capacidad de estimular la proliferación de células T y su diferenciación en células T citotóxicas, estimulando la producción de anticuerpos y la inducción de proteínas de fase aguda [ 10 , 11 ]. Mientras que la IL-10 tiene la capacidad única de inhibir la expresión y producción de muchos genes inducibles por lipopolisacáridos (LPS), principalmente citoquinas proinflamatorias, por parte de los macrófagos [ 12 , 13 ]. Y el IFNγ es producido principalmente por células T CD4 + o CD8 + activadas y células asesinas naturales (NK) y se reconoce como el principal mediador de la inmunidad innata y adaptativa [ 14 , 15 ]. Por lo tanto, validar su selección como GONP podría resultar potencialmente en inmunotoxicidad. Los estudios también demostraron que las GONP exhibían efectos antibacterianos contra bacterias gramnegativas y grampositivas [ 16 ].El objetivo del estudio actual fue investigar los efectos in vitro de las GONP en el sistema inmunológico mediante la exposición de la línea celular de macrófagos murinos, RAW 264.7 y cultivos de células sanguíneas humanas enteras a las GONP. Se monitorearon varios biomarcadores del sistema inmunológico, como citotoxicidad, biomarcadores inflamatorios, citocinas del sistema inmunológico adquirido y un análisis del perfil del proteoma de citocinas y quimiocinas expresadas tras la exposición a GONP.
2. Resultados
2.1. Los efectos de las GONP en las células RAW 264.7
Los efectos de las GONP en MIP-1β utilizando células RAW 264.7Los cultivos expuestos a concentraciones de GONP en el rango de 15,6 a 31,25 aumentaron significativamente ( p <0,001) la cantidad de MIP-1β secretada por las células RAW en comparación con el control de cultivo no expuesto a GONP ( Figura 1 e). Por otro lado, las concentraciones de GONP ≥ 62,5 μg/ml redujeron significativamente la síntesis de MIP-1β en comparación con el control de cultivo que no contenía nanopartículas. Los resultados de los medios expuestos únicamente a LPS en ausencia de GONP (1127,19 ± 468,69 ng/mL MIP-1β) no se incluyen en la figura.
Los efectos de las GONP en MIP-2 utilizando células RAW 264.7Las concentraciones de GONP ≤ 62,5 μg/ml aumentaron significativamente ( p <0,001) la síntesis de MIP-2 en comparación con los cultivos de control expuestos a medios solo sin ninguna nanopartícula ( Figura 1 f). La síntesis de MIP-2 no se vio afectada por concentraciones de GONP ≥ 125 μg/ml. Los medios en presencia de LPS sin GONP (307,39 ± 171,86 ng/mL MIP-2) no están incluidos en la figura.
3. Discusión
El grafeno ha atraído mucha atención debido a sus numerosas aplicaciones industriales y médicas potenciales. Sin embargo, se sabe muy poco sobre los efectos de estas nanopartículas en el sistema inmunológico. La exposición de células RAW a GONP indujo citotoxicidad en la concentración más alta (500 μg/ml). Li et al. obtuvieron datos similares. que expusieron grafeno prístino a células RAW 264,7 [ 17 ]. Propusieron que las GONP ejercían sus efectos citotóxicos al agotar el potencial de la membrana mitocondrial y aumentar la producción de ROS. La disminución de la viabilidad celular también podría atribuirse a la mayor capacidad de los macrófagos para internalizar GO y esto podría haber afectado el ensamblaje de actina dentro de la célula [ 18 , 19 ]. También se informó de una reducción en la viabilidad celular al exponer células THP-1 humanas a GONP, lo que indica efectos citotóxicos constantes contra macrófagos y monocitos, independientemente de la especie [ 4 ].En el estudio actual, los datos de perfiles inflamatorios y proteomas para GONP, en condiciones basales, aumentaron la síntesis de citocinas y quimiocinas inflamatorias como NO, IL-6, TNF-α, MIP y RANTES. Estos hallazgos fueron corroborados por Orecchioni et al. como se informó que, las GONP estimularon significativamente la secreción de citocinas Th 1 / Th 2 , como IL-1a, IL-6, IL-10, TNF-α y GM-CSF, así como quimiocinas como MCP-1. , MIP-1α, MIP-1β y RANTES en macrófagos murinos primarios e inmortalizados [ 20 ]. Esto indica la activación de los macrófagos por GONP y potencialmente podría atribuirse a la interacción de GONP con los receptores tipo peaje [ 21 , 22 ]. Feito et al. encontró que las células RAW 264.7 expuestas a poli (etilenglicol-amina) (PEG) funcionalizaban el TNF-α con regulación positiva de GO en condiciones basales y estimuladas con LPS [ 18 ]. Se encontró que la IL-6 estaba regulada negativamente a 25 y 100 μg/ml de GO en una respuesta inflamatoria simulada (+LPS). No se observaron diferencias en los niveles de IL-6 en condiciones basales. El resultado de TNF-α obtenido por Feito et al. es consistente con lo que se encontró en el estudio actual utilizando perfiles de proteoma [ 18 ]. La citocina inflamatoria, IL-6, se reguló significativamente a 15,6 y 31,25 μg/ml en ausencia de un mitógeno en el estudio actual. Esto es contradictorio con lo encontrado por Feito et al, pero podría atribuirse a la funcionalización de GO [ 18 ]. La funcionalización de nanopartículas con polímeros biocompatibles aumenta su estabilidad en condiciones fisiológicas. También minimiza sus interacciones con otras biomoléculas y reduce las respuestas inmunológicas [ 8 , 18 ]. Los efectos de las GONP en las células RAW, en condiciones estimuladas con LPS, no se evaluaron en el estudio actual.De manera similar a las células RAW, las GONP también indujeron citotoxicidad en cultivos de células sanguíneas enteras a 500 μg/ml, y Orecchioni et al. expuso GONP a células mononucleares de sangre periférica (PBMC) y descubrió que inducía sus efectos citotóxicos al inducir la apoptosis mediada por ROS [ 6 , 23 ]. Zhi et al. También encontró que GO indujo la apoptosis en los linfocitos T de una manera dependiente de la dosis [ 24 ].La exposición de cultivos de células sanguíneas enteras a GONP también indujo la regulación positiva de las citocinas inflamatorias IL-6 y MIP-1β en condiciones basales/no estimuladas. Esta activación de la respuesta inflamatoria podría atribuirse a la activación del sistema del complemento que resulta en la producción de anafilatoxinas (mediadores proinflamatorios). Esto puede ocurrir porque los componentes del sistema del complemento pueden detectar GO tan pronto como GO se introduce en un sistema biológico [ 25 ]. La activación del sistema del complemento fue estudiada por Wibroe et al. quienes encontraron que había un aumento en C5a, que es un marcador de la activación del sistema del complemento cuando se expone suero humano a GO [ 26 ]. Wibroe et al. También descubrió que GO reducía la síntesis de IL-6 cuando el suero humano era estimulado por LPS, lo que concuerda con lo encontrado en este estudio [ 26 ]. Los datos del perfil de proteoma obtenidos en el estudio actual confirmaron que las citocinas y quimiocinas inflamatorias se activaron cuando los cultivos de células sanguíneas enteras se expusieron a 5 μg/ml de GONP. En particular, las GONP regulaban positivamente IL-1ra, MCP-1, MIP-1α/β e IL-8.Las GONP no solo inhibieron una respuesta inflamatoria de manera dosis dependiente, sino que también modularon las citoquinas que regulan las respuestas inmunes adaptativas. Las GONP estimularon la síntesis de la citocina humoral reguladora del sistema inmune, IL-10, pero no afectaron la respuesta mediada por células que regula la citoquina, IFNγ, de cultivos de células sanguíneas completas en condiciones basales/no estimuladas. Esto indica que las GONP inducirían la diferenciación de células Th 0 a células Th 2 . Luego, las interleucina 4 y 10 (IL-4 e IL-10) estimulan a los linfocitos B para que produzcan anticuerpos para combatir la exposición a las GONP [ 27 ]. Sin embargo, las respuestas de IL-10 e IFNγ en cultivos de células sanguíneas completas en condiciones estimuladas por PHA fueron reguladas negativamente por las GONP.Este estudio indica claramente que las GONP son citotóxicas en altas concentraciones y estimulan la activación de respuestas inflamatorias en condiciones basales/no estimuladas. Esta activación/estimulación de una respuesta inflamatoria podría causar autoinmunidad en individuos expuestos a GONP [ 28 ]. En condiciones basales/no estimuladas, las GONP también estimularían una respuesta inmune humoral en individuos expuestos a ellas. Sin embargo, en condiciones estimuladas que imitaban una infección, las respuestas humorales y celulares estaban reguladas a la baja, lo que indica una posible inmunosupresión por la exposición a GONP en individuos con una infección.Los datos obtenidos en el estudio actual son cruciales para la gestión de riesgos de las personas tras la exposición a GONP, ya que estas nanopartículas podrían usarse in vivo como sistemas de administración de fármacos, entre otras aplicaciones. Los GONP también pueden liberarse al medio ambiente y potencialmente afectar la salud humana.
4. Materiales y métodos
Expresiones de gratitud
Los autores desean agradecer a la Fundación Nacional de Investigación (NRF) por financiar este estudio.
Contribuciones de autor
Edmund Pool concibió y diseñó los experimentos in vitro. También ayudó a escribir el manuscrito. María Fidalgo concibió, diseñó y ayudó en la redacción de los experimentos de GONP; Mohamed Bayati sintetizó, caracterizó y redactó los GONP; Kim Lategan y Hend Alghadi realizaron los experimentos y analizaron los datos; Kim Lategan escribió el artículo.
Conflictos de interés
Los autores declaran no tener ningún conflicto de intereses.
Apéndice A
Los espectros FTIR de GO se presentan en la Figura A1 . Se confirmaron diferentes tipos de funcionalidades del oxígeno en el espectro GO: a 3300 cm −1 (vibración de estiramiento O – H), a 1740 cm −1 (vibración de estiramiento de C=O), a 1619 cm −1 (estiramiento C=C) , a 1360 cm −1 (estiramiento C – O), a 1201 cm −1 (vibración de estiramiento C – OH) y finalmente a 1060 cm −1 (vibración de estiramiento C – O). Los espectros de adsorción UV-vis de las láminas GO mostraron un pico característico a 227 nm ( Figura A2 ) debido a la transición π→π* de los enlaces C=C. La Figura A3 muestra una imagen TEM representativa de una partícula GO, sedimentada a partir de una suspensión a pH = 5,2 y ausencia de electrolitos agregados, lo que evidencia su morfología bidimensional. Las dimensiones de las láminas observadas fueron de aproximadamente 1 a 2 µm, aunque se detectaron algunas partículas más pequeñas probablemente debido a la rotura parcial de las láminas GO iniciales. Sin embargo, en presencia de NaCl 10 mM, el tamaño de las láminas de GO disminuyó de 1555 ± 248,57 nm a 519,97 ± 36,59 nm a medida que el pH aumentó de 2 a 11 ( Tabla A1 ). La Figura A4 muestra que el potencial ζ de las partículas GO fue negativo en el rango de pH de 2 a 11. En presencia de NaCl 10 mM, los valores del potencial ζ disminuyeron de −23,24 ± 0,72 a −51,1 ± 1,04 mV a medida que aumentaba el pH. de 2 a 11 debido a la desprotonación de grupos funcionales de oxígeno [ 32 ]. La curva de potencial ζ versus pH mostró dos puntos de inflexión, ubicados alrededor de pH 4 y pH 9. Los espectros FTIR ( Figura A1 ) mostraron que GO tiene dos tipos de grupos ácidos: carboxílicos (pKa, 4,3) e hidroxílicos (pKa, 9,3). ); El aumento de cargas negativas en las hojas GO resultó de la ionización de estos dos grupos [ 33 ].

Figura A1. Análisis de GONP por espectroscopía infrarroja por transformada de Fourier (FTIR).

Figura A2. Espectrofotometría ultravioleta-visible (UV-vis) de GONP, con absorbancia máxima a 227 nm.
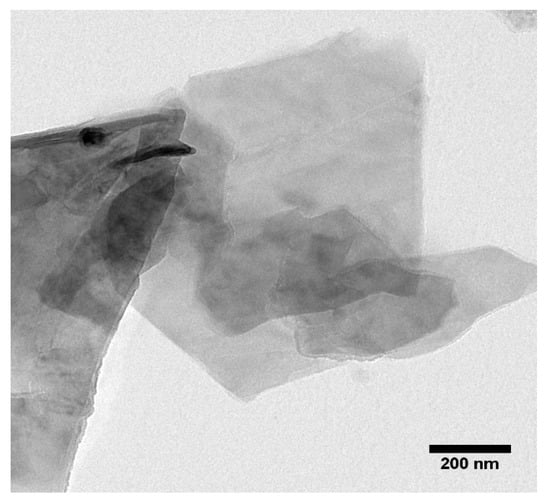
Figura A3. Visualización de láminas de grafeno mediante microscopía electrónica de transmisión (TEM).

Referencias
- Chen, M.; Yin, J.; Liang, Y.; Yuan, S.; Wang, F.; Canción, M.; Wang, H. Estrés oxidativo e inmunotoxicidad inducida por óxido de grafeno en pez cebra. Agua. Toxico. 2016 , 174 , 54–60. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chen, X.; Hai, X.; Wang, J. Grafeno/óxido de grafeno y sus derivados en la separación/aislamiento y preconcentración de especies de proteínas: una revisión. Anal. Chim. Acta 2016 , 922 , 1–10. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Liu, B.; Salgado, S.; Maheshwari, V.; Liu, J. ADN adsorbido en grafeno y óxido de grafeno: interacciones fundamentales, desorción y aplicaciones. actual. Opinión. Ciencia de la interfaz coloidal. 2016 , 26 , 41–49. [ Google Scholar ] [ CrossRef ]
- Lu, C.-J.; Jiang, X.-F.; Junaid, M.; Ma, Y.-B.; Jia, P.-P.; Wang, H.-B.; Pei, D.-S. Las nanohojas de óxido de grafeno inducen daños en el ADN y activan la vía de señalización de reparación por escisión de bases (BER) tanto in vitro como in vivo. Quimiosfera 2017 , 184 , 795–805. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Sotirelis, NP; Chrysikopoulos, CV Heteroagregación de nanopartículas de óxido de grafeno y coloides de caolinita. Ciencia. Medio ambiente total. 2017 , 579 , 736–744. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Cherian, RS; Sreejith, R.; Syama, S.; Sruthi, S.; Gayathri, V.; Maekawa, T.; Sakthikumar, D.; Mohanan, P. Evaluación de la toxicidad del óxido de grafeno reducido de Maura utilizando sistemas in vitro. J. Nanomed. Nanotecnología. 2014 , 5 , 200. [ Google Scholar ]
- Zhang, W.; Yao, Y.; Li, K.; Huang, Y.; Chen, Y. Influencia del oxígeno disuelto en la cinética de agregación de nanopartículas de plata recubiertas de citrato. Reinar. Contaminación. 2011 , 159 , 3757–3762. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Peruzyńska, M.; Cendrowski, K.; Barylak, M.; Tkacz, M.; Piotrowska, K.; Kurzawski, M.; Mijowska, E.; Drozdzik, M. Estudio comparativo in vitro de nanocopos de óxido de grafeno de una y cuatro capas: citotoxicidad y absorción celular. Toxico. In Vitro 2017 , 41 , 205–213. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yan, J.; Chen, L.; Huang, C.-C.; Pulmón, S.-CC; Yang, L.; Wang, W.-C.; Lin, P.-H.; Suo, G.; Lin, C.-H. Evaluación consecutiva de la inmunotoxicidad del óxido de grafeno y de las nanoplaquetas de óxido de grafeno reducidas en monocitos. Surf de coloides. B Biointerfaces 2017 , 153 , 300–309. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Hibi, M.; Nakajima, K.; Hirano, T. Familia de citocinas IL-6 y transducción de señales: un modelo del sistema de citocinas. J. Mol. Medicina. 1996 , 74 , 1–12. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Niemand, C.; Nimmesgern, A.; Haan, S.; Fischer, P.; Schaper, F.; Rossaint, R.; Heinrich, PC; Muller-Newen, G. La activación de STAT3 por IL-6 e IL-10 en macrófagos humanos primarios está modulada diferencialmente por el supresor de la señalización de citocinas 3. J. Immunol. 2003 , 170 , 3263–3272. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Donnelly, RP; Dickensheets, H.; Finbloom, DS La vía de transducción de señales de interleucina-10 y la regulación de la expresión génica en fagocitos mononucleares. J. Interferón Citocina Res. 1999 , 19 , 563–573. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Riley, JK; Takeda, K.; Akira, S.; Schreiber, RD La señalización del receptor de interleucina-10 a través de la vía JAK-STAT requiere dos señales distintas derivadas del receptor para la acción antiinflamatoria. J. Biol. Química. 1999 , 274 , 16513–16521. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Schröder, K.; Hertzog, PJ; Ravasi, T.; Hume, DA Interferón-γ: una descripción general de señales, mecanismos y funciones. J. Leukoc. Biol. 2004 , 75 , 163–189. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Mühl, H.; Pfeilschifter, J. Propiedades antiinflamatorias del interferón-γ proinflamatorio. En t. Inmunofarmacol. 2003 , 3 , 1247–1255. [ Google Scholar ] [ CrossRef ]
- Akhavan, O.; Ghaderi, E. Toxicidad de las nanoparedes de grafeno y óxido de grafeno contra las bacterias. ACS Nano 2010 , 4 , 5731–5736. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Li, Y.; Liu, Y.; Fu, Y.; Wei, T.; Le Guyader, L.; Gao, G.; Liu, R.-S.; Chang, YZ; Chen, C. La activación de la apoptosis en macrófagos mediante grafeno prístino a través de las vías de señalización MAPK y TGF-beta. Biomateriales 2012 , 33 , 402–411. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Feitó, M.; Vila, M.; Matesanz, M.; Linares, J.; Gonçalves, G.; Marqués, P.; Vallet-Regí, M.; Rojo, J.; Portolés, M. Evaluación in vitro de nanohojas de óxido de grafeno sobre la función inmune. J. Ciencia de la interfaz coloidal. 2014 , 432 , 221–228. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Versión verde ]
- Zhang, B.; Wei, P.; Zhou, Z.; Wei, T. Interacciones del grafeno con células de mamíferos: mecanismos moleculares y conocimientos biomédicos. Adv. Entrega de drogas. Rev. 2016 , 105 , 145–162. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Orecchioni, M.; Ménard-Moyon, C.; Delogu, LG; Bianco, A. El grafeno y el sistema inmunológico: desafíos y potencialidades. Adv. Entrega de drogas. Rev. 2016 , 105 , 163–175. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chen, P.; Kanehira, K.; Taniguchi, A. Papel de los receptores tipo peaje 3, 4 y 7 en la captación celular y la respuesta a las nanopartículas de dióxido de titanio. Ciencia. Tecnología. Adv. Madre. 2013 , 14 , 015008. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Mano, SS; Kanehira, K.; Taniguchi, A. Comparación de la captación celular y la respuesta inflamatoria a través del receptor tipo peaje 4 con nanopartículas de lipopolisacárido y dióxido de titanio. En t. J. Mol. Ciencia. 2013 , 14 , 13154–13170. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Orecchioni, M.; Jasim, DA; Pescatori, M.; Manetti, R.; Fozza, C.; Sgarrella, F.; Bedonetti, D.; Blanco, A.; Kostarelos, K.; Delogu, LG Impacto molecular y genómico de láminas de óxido de grafeno de dimensiones laterales grandes y pequeñas en células inmunes humanas de donantes sanos. Adv. Saludc. Madre. 2016 , 5 , 276–287. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhi, X.; Colmillo, H.; Bao, C.; Shen, G.; Zhang, J.; Wang, K.; Guo, S.; Desear.; Cui, D. La inmunotoxicidad de los óxidos de grafeno y el efecto del recubrimiento de PVP. Biomateriales 2013 , 34 , 5254–5261. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Saleem, J.; Wang, L.; Chen, C. Efectos inmunológicos de los nanomateriales de la familia del grafeno. NanoImpact 2017 , 5 , 109-118. [ Google Scholar ] [ CrossRef ]
- Wibroe, PP; Petersen, SV; Bovet, N.; Laursen, BW; Moghimi, SM El óxido de grafeno soluble e inmovilizado activa el sistema del complemento de forma diferente según el estado de oxidación de la superficie. Biomateriales 2016 , 78 , 20–26. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Bronceado, TT; Coussens, LM Inmunidad humoral, inflamación y cáncer. actual. Opinión. Inmunol. 2007 , 19 , 209–216. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- De Jong, WH; Van Loveren, H. Detección de xenobióticos para detectar inmunotoxicidad directa en un estudio con animales. Métodos 2007 , 41 , 3–8. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Humers, W.; Offeman, R. Preparación de óxido grafítico. Mermelada. Química. Soc. 1958 , 80 , 1339. [ Google Scholar ] [ CrossRef ]
- Elimelec, M.; Gregorio, J.; Jia, X.; Williams, R. Medición, modelado y simulación de agregación y deposición de partículas , 1ª ed.; Butterworth-Heinemann Ltd.: Woburn, MA, EE. UU., 1995. [ Google Scholar ]
- Granger, DL; Taíntor, RR; Boockvar, KS; Hibbs, JB Medición de nitrato y nitrito en muestras biológicas mediante nitrato reductasa y reacción de Griess. Métodos Enzimol. 1996 , 268 , 142-151. [ Google Académico ] [ PubMed ]
- Chowdhury, I.; Duch, MC; Mansukhani, ND; Hersam, MC; Bouchard, D. Propiedades coloidales y estabilidad de los nanomateriales de óxido de grafeno en el medio acuático. Reinar. Ciencia. Tecnología. 2013 , 47 , 6288–6296. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhao, J.; Liu, F.; Wang, Z.; Cao, X.; Xing, B. Heteroagregación de óxido de grafeno con minerales en fase acuosa. Reinar. Ciencia. Tecnología. 2015 , 49 , 2849–2857. [ Google Scholar ] [ CrossRef ] [ PubMed ]

Figura 1. Macrófagos murinos, células RAW 264.7 después del tratamiento con GONP. Los parámetros evaluados ( a ) viabilidad celular; ( b ) producción de óxido nítrico; ( c ) Producción de interleucina 6 (IL-6); ( d ) Niveles de proteína inflamatoria 1 alfa (MIP-1α) de macrófagos. Control positivo no representado (803,85 ± 353,70 ng/mL MIP-1α); ( mi ) Niveles de MIP-1β. Control positivo no representado (1127,19 ± 468,69 ng/mL MIP-1β); y ( f ) niveles MIP-2. Control positivo no representado (307,39 ± 171,86 ng/mL MIP-2). Los datos representan la media ± DE con n = 9. Las barras marcadas con símbolos indican una diferencia significativa con el control ( p < 0,01). Importancia demarcada por: *: significativamente diferente en comparación con el control negativo ( p < 0,001), # : significativamente diferente en comparación con el control positivo ( p ≤ 0,005).

Figura 2. El efecto de las nanopartículas de óxido de grafeno (GONP) en células RAW 264.7. Las células se incubaron con ( a ) solo medio (control negativo); ( b ) medios en presencia de LPS y ( c ) 15,6 μg / ml de GONP en ausencia de un mitógeno. Los sobrenadantes se sondaron utilizando la matriz de perfilador de proteoma como se describe en los métodos. A las citocinas/quimiocinas que se detectaron se les asignaron números: 1, 3 y 16 son puntos de referencia; 2-IP-10; 4-G-CSF; 5-TNF-α; 6-GM-CSF; 7-IL-6; 8-JE; 9-sICAM-1; 10-MIP-1α; 11-MIP-1β; 12-IL-1β; 13-MIP-2; 14-IL-1ra; 15-RANTES; 17-IL-27; 18-SDF-1.

Figura 3. Cuantificación de citoquinas secretadas por cultivos RAW 264.7 no estimulados con LPS después del tratamiento con medio solo o medio que contiene 15,6 μg/ml de GONP. Membranas sometidas a exposición cromogénica. Los datos se representan como media ± DE. Las barras marcadas con símbolos indican diferencias significativas ( p < 0,01). Importancia demarcada por: *: significativamente diferente en comparación con el control negativo ( p < 0,001), # : significativamente diferente en comparación con el control positivo ( p < 0,001).

Figura 4. Viabilidad celular de cultivos de células sanguíneas enteras expuestas a GONP. Los datos representan la media ± DE con n = 4. Las barras marcadas con el símbolo indican una diferencia significativa con el control ( p < 0,01). Importancia demarcada por: *: significativamente diferente en comparación con el control negativo ( p < 0,003).

Figura 5. Niveles de expresión de biomarcadores inflamatorios de cultivos de células sanguíneas enteras expuestos a GO. NP en ausencia o presencia de LPS: ( a ) niveles de expresión de IL-6 y ( b ) niveles de expresión de MIP-1β. Los datos representan la media ± DE con n = 4. Las barras marcadas con símbolos indican diferencias significativas ( p < 0,01). Importancia demarcada por: *: significativamente diferente en comparación con el control negativo ( p < 0,001), #: significativamente diferente en comparación con el control positivo ( p < 0,001).


Figura 7. Los efectos de las GONP en las células sanguíneas completas. Las células se incubaron con ( a ) solo medio, ( b ) medio y LPS, ( c ) 5 μg / ml de GONP en ausencia de LPS. A las citocinas/quimiocinas que se detectaron se les asignaron números: 1, 2 y 13 son puntos de referencia; 3-IL-1ra; 4-FOMIN; 5-MCP-1; 6-Serpina E1; 7-MIP-1α/β; 8-RANTES; 9-ICAM-1, 10-IL-6, 11-IL-8 y 12-IL-1β.

Figura 8. Cuantificación de citocinas secretadas por cultivos de células sanguíneas completas no estimuladas con LPS después del tratamiento con medio solo o con medio que contiene 5 μg/ml de GONP. Membranas sometidas a exposición cromogénica. Los datos se representan como media ± DE. Las barras marcadas con símbolos indican diferencias significativas ( p < 0,01). Importancia demarcada por: *: significativamente diferente en comparación con el control negativo ( p < 0,001), # : significativamente diferente en comparación con el control positivo ( p < 0,001).
© 2018 por los autores. Licenciatario MDPI, Basilea, Suiza. Este artículo es un artículo de acceso abierto distribuido bajo los términos y condiciones de la licencia Creative Commons Attribution (CC BY) ( http://creativecommons.org/licenses/by/4.0/ ).
